УДК 582.573.46:633.88 doi: 10.21498/25181017.19.4.2023.291224
О. В. Сокол*, Д. Б. Рахметов, Н. І. Джуренко, О. П. Паламарчук
Національний ботанічний сад імені М. М. Гришка НАН України, вул. Садовоботанічна, 1, м. Київ, 01014, Україна,
*email: sokoloksana23@ukr.net
Мета. Дослідити накопичення катехінів, антоціанів, лейкоантоціанів та аскорбінової кислоти в рослинах видів роду Arctium, інтродукованих у Національному ботанічному саду імені М. М. Гришка. Методи. Об’єктом досліджень слугували інтродуковані рослини роду Arctium, а саме: A. lappa L. (лопух справжній), A. tomentosum Mill. (лопух повстистий), A. nemorosum Lej. (лопух дібровний) та A. minus Bernh (лопух малий). Фітохімічні аналізи дослідних зразків органів рослин проводили у різних фазах онтогенезу. Вільні катехіни, антоціани та лейкоантоціани визначали фотоколориметричним методом. Результати. Встановлено, що рослини другого року вегетації накопичують більше катехінів ніж однорічні. Максимальна їх кількість – у листкових пластинках A. lappa та A. minus у фазі бутонізації (180,0 ± 0,3 та 144,0 ± 0,1 мг% відповідно). Вміст лейкоантоціанів у листкових пластинках однорічних рослин варіював від 72,0 ± 0,4 (A. lappa) до 660,0 ± 0,6 мг% (A. minus); дворічних – від 18,0 ± 0,6 (A. nemorosum) до 165,0 ± 0,5 мг% (A. lappa). Найбільше цих сполук виявлено в листковій пластинці A.minus першого року вегетації. Кількість антоціанів у листкових пластинках однорічних рослин змінювалася від 9,0 ± 0,1 (A. nemorosum) до 42,0 ± 0,4 мг% (A. minus), у черешках – від 9,8 ± 0,06 (A. tomentosum) до 117,0 ± 0,6 мг% (A. minus). На другий рік вегетації їх накопичення становило від 12,0 ± 0,3 (A. minus) до 42,0 ± 0,6 мг% (A. tomentosum) у листкових пластинках та від 9,6 ± 0,1 (A. tomentosum) до 48,0 ± 0,1 мг% (A. nemorosum) у черешках. Найбільше антоціанів виявлено в черешках A. minus першого року вегетації. Висновки. За результатами фітохімічних досліджень встановлено, що рослини видів роду Arctium, інтродуковані в Національному ботанічному саду імені М. М. Гришка, протягом вегетації накопичують різну кількість фенольних сполук. Виявлено залежність між часткою флавоноїдів у листках та температурою повітря. Збільшення вмісту антоціанів відбувається за зниження температури, а катехінів, навпаки, – за її підвищення. Максимальна кількість аскорбінової кислоти накопичується в листкових пластинках однорічних рослин видів роду Arctium.
Ключові слова: види роду Arctium; лікарська рослинна сировина; катехіни; антоціани; лейкоантоціани; аскорбінова кислота.
Oksana Sokol
https://orcid.org/0000000262977912
Dzhamal Rakhmetov
https://orcid.org/0000000172603263
Nadiia Dzhurenko
https://orcid.org/000000018210445X
Olena Palamarchuk
https://orcid.org/0000000286496806
Вступ
Попри швидкий розвиток фармацевтичної промисловості та розширення асортименту синтетичних препаратів рослини все ще залишаються одним з основних джерел біологічно активних сполук для виробництва як лікарських, так і фітозасобів лікувально-профілактичного спрямування. Інтродукційні дослідження та процес введення рослин у культуру передбачають виявлення закономірностей між метаболізмом і накопиченням цінних речовин вторинного обміну. Важливе значення має вивчення динаміки накопичення в рослинах біологічно активних сполук з максимальним вмістом у фітосировині.
На особливу увагу заслуговують розповсюджені в усьому світі представники роду Arctium L. Загалом їх існує 19 видів, чотири – поширені в Україні [1], де їх використовують у медичній практиці, для лікування шлунково-кишкового тракту та стимулювання протипухлинної активності [2–4]. Результати фітохімічного скринінгу свідчать, що рослини видів роду Arctium здатні впродовж вегетаційного періоду синтезувати та акумулювати у високих концентраціях збалансований комплекс важливих біологічно активних сполук із широким спектром фізіологічної дії, що зумовлює поліфункціональність лікарських властивостей.
Натепер існують нечисленні дослідження з накопичення в сировині рослин видів роду Arctium таких фенольних сполук, як катехіни, лейкоантоціани та антоціани. Окремі публікації стосуються виявлення в сировині A. minus та A. lappa флавонолів, флавонів та їхніх глікозидів [5–9]. Різні органи рослин A. lappa синтезують різні флавоноїдні сполуки та накопичують неоднакову їх кількість. Зокрема, в коренях виявлено лютеолін і рамнозид кверцетина, в листках – рутин, кверцетин, кверцитрин і лютеолін, у сім’янках не знайдено жодного флавоноїда [10, 11].
У Харківському національному фармацевтичному університеті визначили кількісний вміст суми окиснюваних фенолів, гідроксикоричних кислот, флавоноїдів і дубильних речовин у коренях осінньої та весняної заготівлі, прикореневому та стебловому листі, стеблі, суцвітті та його осі, плодах, густих екстрактах коренів і листя A. lappa. Так, найвища сума окиснюваних фенолів (7,53 ± 0,51%) притаманна сім’янкам; гідроксикоричних кислот (1,85 ± 0,06%) і флавоноїдів (1,66 ± 0,06%) – прикореневому листю; дубильних речовин (1,29 ± 0,08%) – стеблу. В густому екстракті коренів також спостерігали значний вміст суми окиснюваних фенолів (13,78 ± 0,95%); у густому екстракті листя – гідроксикоричних кислот (4,24 ± 0,16%), флавоноїдів (4,00 ± 0,14%) і дубильних речовин (1,04 ± 0,07%) [12].
У процесі дослідження сировини рослин A. lappa (коренів, листків і сім’янок), що культивується в Єгипті, виявлено та вивчено якісно й кількісно 13 фенольних сполук, основними з яких були лігнани. Найбільшу антиоксидантну, гепатопротекторну, протизапальну та цитотоксичну активність встановлено для екстрактів насіння, що, ймовірно, можна пояснити високим вмістом фенольних сполук, зокрема флавоноїдів, лігнанів і фенольних кислот [13].
Італійськими вченими доведено антиоксидантну активність фенольних сполук у сім’янках, листках і коренях рослин A. lappa [11]. Дослідники найчастіше відзначають максимальне накопичення флавоноїдів під час бутонізації [14, 15], втім деякі вказують на найбільше їх скупчення у фазі квітування [16, 17]. На відміну від фенольних речовин аскорбінова кислота накопичується в листках першого року вегетації, тоді як на другий рік її вміст зменшується майже вдвічі- в????? [5, 11].
тричі [5, 11].
З огляду на те, що велику вегетативну масу рослин роду Arctium раціонально не використовують, доцільно визначати рівень і характер накопичення фенольних сполук та аскорбінової кислоти протягом вегетації. Це дасть змогу виявляти перспективний генетичний потенціал особливо цінних рослин з метою подальшого використання в селекції та медичній практиці для створення ефективних лікувально-профілактичних засобів.
Мета досліджень – встановити особливості накопичення катехінів, антоціанів, лейкоантоціанів та аскорбінової кислоти в рослинах видів роду Arctium впродовж їхньої вегетації.
Матеріали та методика досліджень
Об’єктом досліджень слугували рослини чотирьох видів роду Arctium L. з колекції «Лікарські рослини» Національного ботанічного саду імені М. М. Гришка НАН України (НБС). А саме: A. lappa L. (лопух справжній), A. tomentosum Mill. (лопух повстистий), A. nemorosum Lej. (лопух дібровний) та A. minus Bernh (лопух малий). Біохімічні аналізи дослідних зразків різних частин рослин (коренів, черешків і листкової пластинки) здійснювали у фазах вегетації, відростання, бутонізації та квітування впродовж 2015–2018 рр. Фенольні сполуки та аскорбінову кислоту визначали в біохімічній лабораторії медичної ботаніки НБС. Вільні катехіни, антоціани та лейкоантоціани встановлювали фотоколориметричним методом [19], а вміст аскорбінової кислоти – методом титрування [20]. Біохімічні дослідження проводили у трикратній повторності. Результати обробляли статистично за допомогою комп’ютерної програми «Microsoft Excel 98».
Результати досліджень
Вміст поліфенольних сполук у листкових пластинках і черешках рослин A. lappa, A. tomentosum, A. nemorosum та A. minus першого та другого років вегетації протягом неї змінюється та пов’язаний з видовими особливостями і впливом температури повітря.
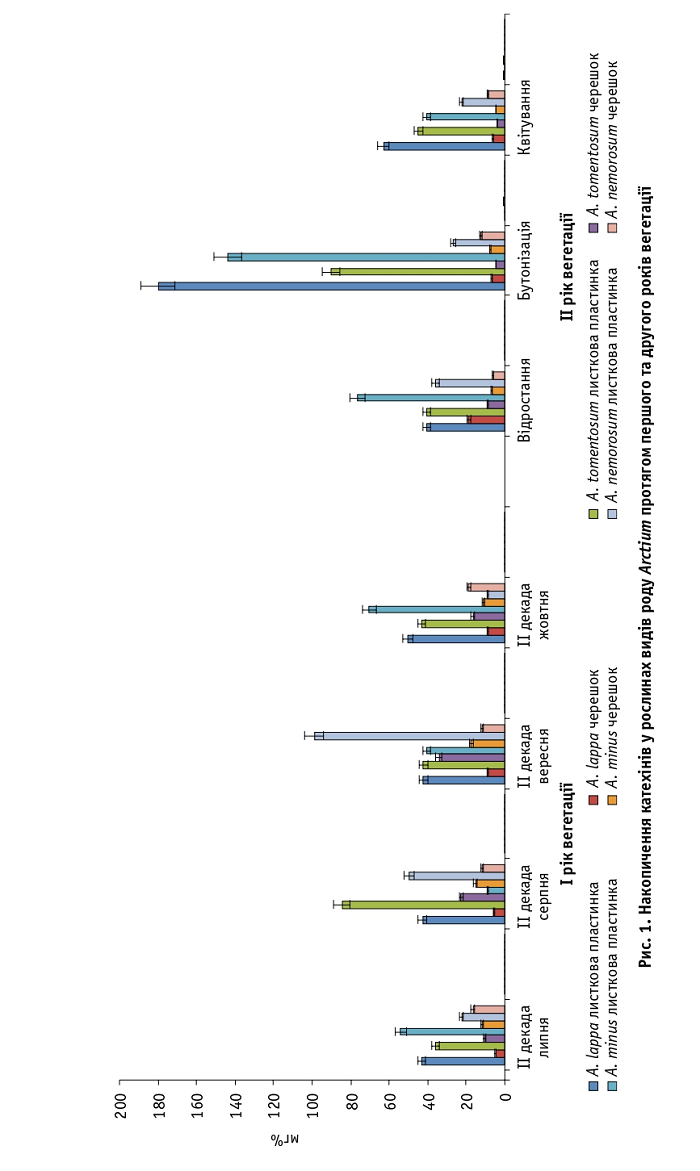
У листкових пластинках рослин A. lappa першого року вегетації вміст катехінів варіював від 42,7 ± 0,1 до 50,4 ± 0,1 мг%, в A. tomentosum – від 36,0 ± 0,1 до 84,60 ± 0,06 мг%, в A. minus – від 9,0 ± 0,1 до 70,5 ± 0,3 мг%, в A. nemorosum – від 9,0 ± 0,08 до 99,0 ± 0,01 мг%. У черешках накопичувалося значно менше цих сполук – від 4,8 ± 0,1 (A. lappa) до 34,2 ± 0,1 мг% (A. tomentosum). Зменшення показників, яке спостерігали наприкінці вегетації, пов’язане зі зниженням температури повітря. Другий рік вегетації характеризувався збільшенням кількості катехінів у листкових пластинках, особливо в A. lappa (180,0 ± 0,3 мг%) та A. minus (144,0 ± 0,1 мг%) у фазі бутонізації, коли фіксували високі температури повітря (рис. 1).
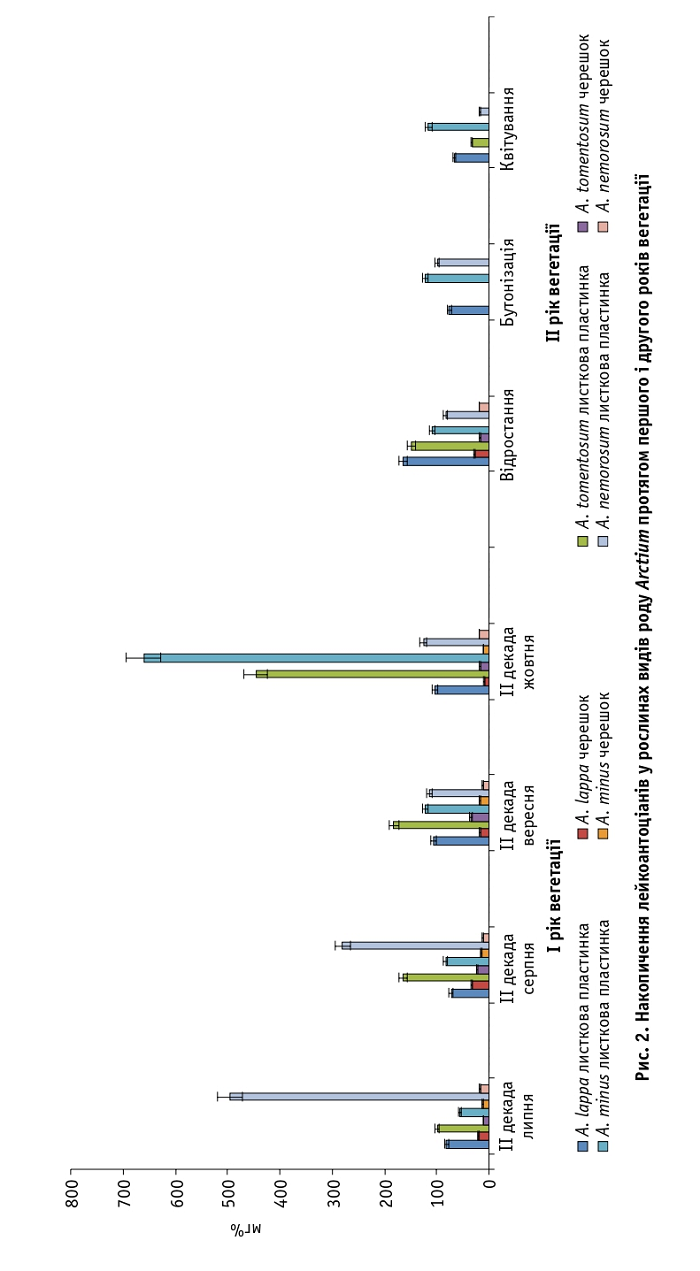
Вміст лейкоантоціанів у листкових пластинках рослин першого року вегетації варіював від 72,0 ± 0,4 (A. lappa) до 660,0 ± 0,6 мг% (A. minus), а в черешках – від 9,0 ± 0,2 (A. lappa) до 34,2 ± 0,1 мг% (A. tomentosum). Їхня кількість на другий рік становила від 18,0 ± 0,6 (A. nemorosum) до 165,0 ± 0,5 мг% (A. lappa) у листкових пластинках і від 16,5 ± 0,3 (A. tomentosum) до 27,5 ± 0,4 мг% (A. lappa) у черешках. Найбільше цих сполук встановлено в рослинах A. minus першого року вегетації (рис. 2).
За результатами статистичного аналізу даних встановлено позитивний кореляційний зв’язок між рівнем накопичення катехінів і лейкоантоціанів.
Для рослин видів A. lappa та A. minus у перший рік вегетації кореляція становила r = 0,43 та 0,67 відповідно, а для A. minus та A. nemorosum у другий рік – r = 0,64 т0,61 (табл. 1).
Таблиця 1
Дані кореляційного зв’язку між накопиченням катехінів і лейкоантоціанів у рослинах видів
роду Arctium першого та другого років вегетації
|
|
A. lappa |
A. minus |
A. tomentosum |
A. nemorosum |
|
Перший рік вегетації |
||||
|
катехіни |
43,2 |
54 |
36 |
22,5 |
|
42,7 |
9 |
84,6 |
49,5 |
|
|
42,3 |
40,5 |
42,3 |
99 |
|
|
50,4 |
70,5 |
43,2 |
9 |
|
|
лейкоантоціани |
81 |
56,1 |
99 |
495 |
|
72 |
82,5 |
165 |
280 |
|
|
106,2 |
122,1 |
181,5 |
113,5 |
|
|
102,6 |
660 |
445,5 |
125,4 |
|
|
r |
0,43 |
0,67 |
–0,14 |
–0,38 |
|
Другий рік вегетації |
||||
|
катехіни |
40,5 |
76,5 |
40,5 |
36 |
|
180 |
144 |
90 |
27 |
|
|
63 |
40,5 |
45 |
22,5 |
|
|
лейкоантоціани |
165 |
108,9 |
148,5 |
82,5 |
|
75,9 |
122,1 |
99 |
99 |
|
|
66 |
115,5 |
33 |
18 |
|
|
r |
–0,55 |
0,64 |
0 |
0,61 |
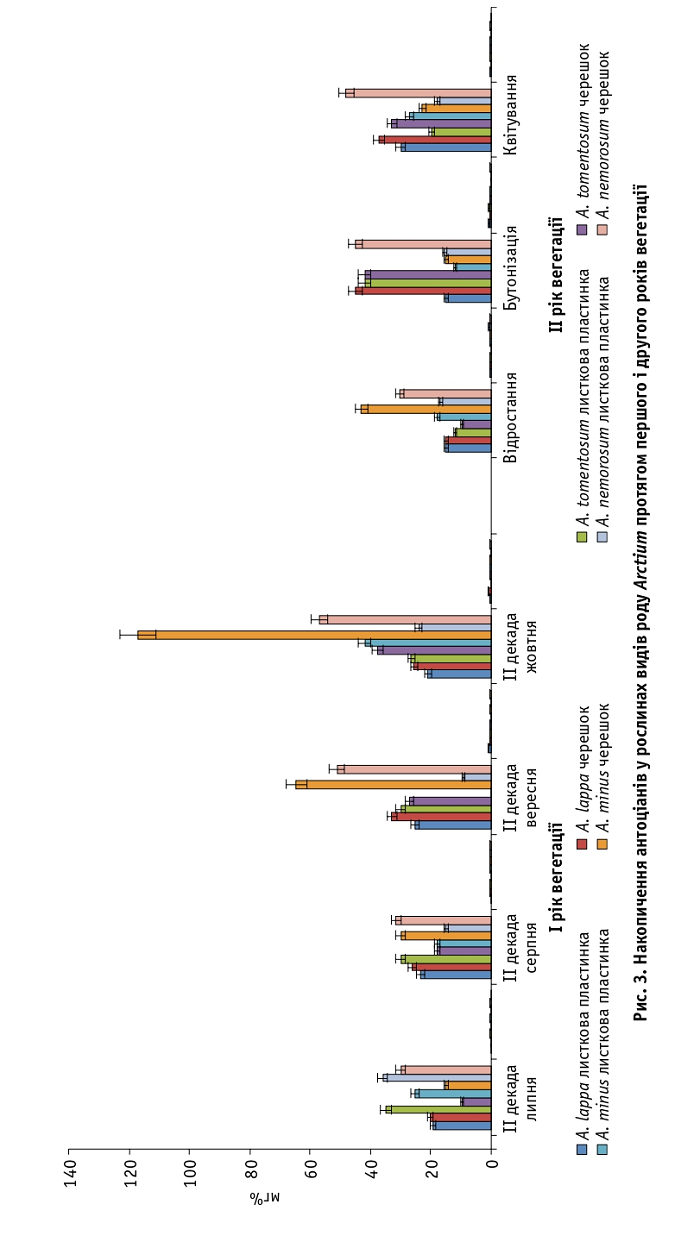
Вміст антоціанів у листкових пластинках першого року вегетації змінювався від 9,0 ± 0,1 (A. nemorosum) до 42,0 ± 0,4 мг% (A. minus), у черешках – від 9,8 ± 0,06 (A. tomentosum) до 117,0 ± 0,6 мг% (A. minus). Їхня кількість на другий рік була меншою – від 12,0 ± 0,3 (A. minus) до 42,0 ± 0,6 мг% (A. tomentosum) у листкових пластинках і від 9,6 ± 0,1 (A. tomentosum) до 48,0 ± 0,1 мг% (A. nemorosum) у черешках. Максимальне накопичення цих сполук виявлено в черешках A. minus наприкінці першого року вегетації, коли знижувалася температура повітря (рис. 3).
Отже, на основі аналізу отриманих даних і літературних джерел щодо інших груп рослин [21] можна зробити висновок, що на кількість флавоноїдних сполук впливає температура повітря, зокрема її зниження збільшує вміст антоціанів, а підвищення – частку катехінів.
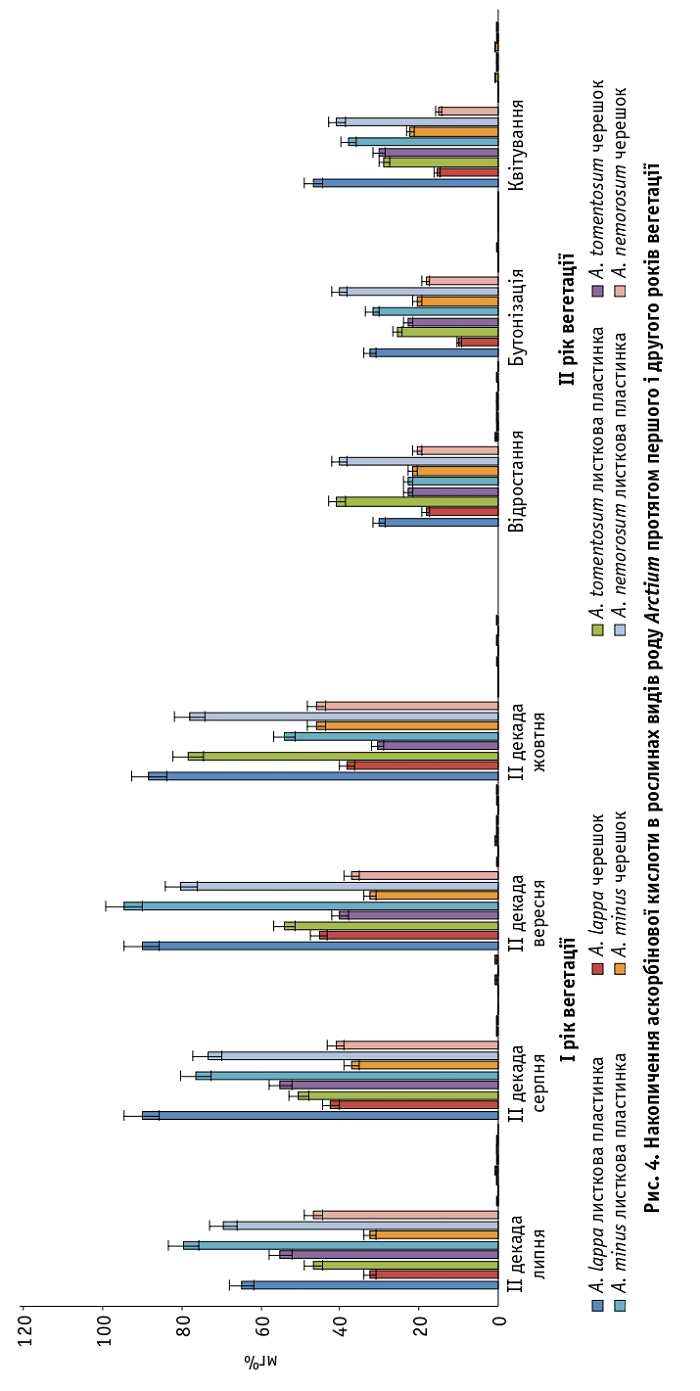
Іншим показником біологічної цінності рослинної сировини, що визначає антиоксидантну активність, є вміст аскорбінової кислоти. Про явище синергізму останньої з флавоноїдами в регуляції окисно-відновних процесів відомо з літературних джерел [22]. Найбільше аскорбінової кислоти містилося в листкових пластинках і черешках рослин роду Arctium першого року вегетації. А саме: в листковій пластинці A. lappa – 90,0 ± 0,2 (серпень, вересень, 2015), а також A. minus – 94,5 ± 0,3 мг% (вересень, 2015) (рис. 4).
Висновки
За результатами досліджень визначено, що рослини залежно від виду накопичують різну кількість флавоноїдних сполук. Так, найбільше катехінів синтезується в листкових пластинках рослин A. lappa та A. tomentosum (180,0 і 144,0 мг%) у фазі бутонізації; максимальний вміст лейкоантоціанів – у листкових пластинках A. minus та A. nemorosum (660,0 і 495,0 мг%) у другій декаді жовтня. В черешках A. minus у другій декаді жовтня встановлено значну кількість антоціанів (117,0 мг%).
На вміст флавоноїдних сполук впливає температура повітря, зокрема її зниження збільшує кількість антоціанів, а підвищення – частку катехінів. Найбільше аскорбінової кислоти містять листкові пластинки однорічних рослин A. minus (94,5 ± 0,3 мг%, вересень) та A. lappa (90,0 ± 0,2 м?%, серпень, вересень), що дає змогу ефективно використовувати рослинну сировину видів роду Arctium.

Використана література
References
UDC 582.573.46:633.88
Sokol, O. V.*, Rakhmetov, D. B., Dzhurenko, N. I., & Palamarchuk, O. P. (2023). Polyphenolic compounds and ascorbic acid of plants of the genus Arctium L. introduced in the M. M. Hryshko National Botanical Garden. Plant Varieties Studying and Protection, 19(4), 270–278. https://doi.org/10.21498/25181017.19.4.2023.291224
Purpose. To study the accumulation of catechins, anthocyanins, leucoanthocyanins and ascorbic acid in plants of the genus Arctium, introduced to the M. M. Hryshko National Botanical Garden. Methods. Introduced plants of the genus Arctium were used for the study, namely A. lappa L. (greater burdock), A. tomentosum Mill. (woolly burdock), A. nemorosum Lej. (wood burdock) and A. minus Bernh (lesser burdock). Phytochemical analyses of plant organ samples were carried out at different stages of ontogeny. Free catechins, anthocyanins and leucoanthocyanins were determined by the photocolorimetric method. Results. It was found that second year plants accumulate more catechins than first year plants. Their maximum amount is found in the leaf plates of A. lappa and A. minus in the budding phase (180.0 ± 0.3 and 144.0 ± 0.1 mg%, respectively). The content of leucoanthocyanins in the leaf plates of oneyearold plants varied from 72.0 ± 0.4 (A. lappa) to 660.0 ± 0.6 mg% (A. minus); twoyearold plants – from 18.0 ± 0.6 (A. nemorosum) to 165.0 ± 0.5 mg% (A. lappa). Most of these compounds were found in the leaf blade of A. minus in the first year of vegetation. The amount of anthocyanins in leaf plates of oneyearold plants varied from 9.0 ± 0.1 (A. nemorosum) to 42.0 ± 0.4 mg% (A. minus), in petioles from 9.8 ± 0.06 (A. tomentosum) to 117.0 ± 0.6 mg% (A. minus). In the second year of vegetation, their accumulation ranged from 12.0 ± 0.3 (A. minus) to 42.0 ± 0.6 mg% (A. tomentosum) in leaf plates and from 9.6 ± 0.1 (A. tomentosum) to 48.0 ± 0.1 mg% (A. nemorosum) in petioles. Most anthocyanins were found in the petioles of A. minus from the first year of vegetation. Conclusions. The phytochemical studies established that plants of the Arctium genus, introduced to the M. Hryshko National Botanical Garden, accumulate varying amounts of phenolic compounds during the growing season. The proportion of flavonoids in leaves was found to be related to air temperature. An increase in temperature leads to a decrease in the content of anthocyanins, while an increase in catechins occurs due to a decrease in temperature. The leaf plates of annual plants belonging to the Arctium genus accumulate the highest levels of ascorbic acid.
Keywords: species of the genus Arctium; medicinal plant raw materials; catechins; anthocyanins; leucoanthocyanins; ascorbic acid.
Надійшла / Received 15.10.2023
Погоджено до друку / Accepted 25.11.2023